近期云序活动,详情点击
云序7周年测序免费送&发文送好礼

影响因子:27.401
发表时间:2022年5月10日
研究方法:m6A MeRIP-seq、RNA-seq、比色法检测整体RNA修饰水平、m6A RNA修饰相关酶PCR芯片、MeRIP-qPCR、RIP-qPCR、双荧光素酶实验
文章链接:N6-methyladenosine-modified TRAF1 promotes sunitinib resistance by regulating apoptosis and angiogenesis in a METTL14-dependent manner in renal cell carcinoma
技术路线
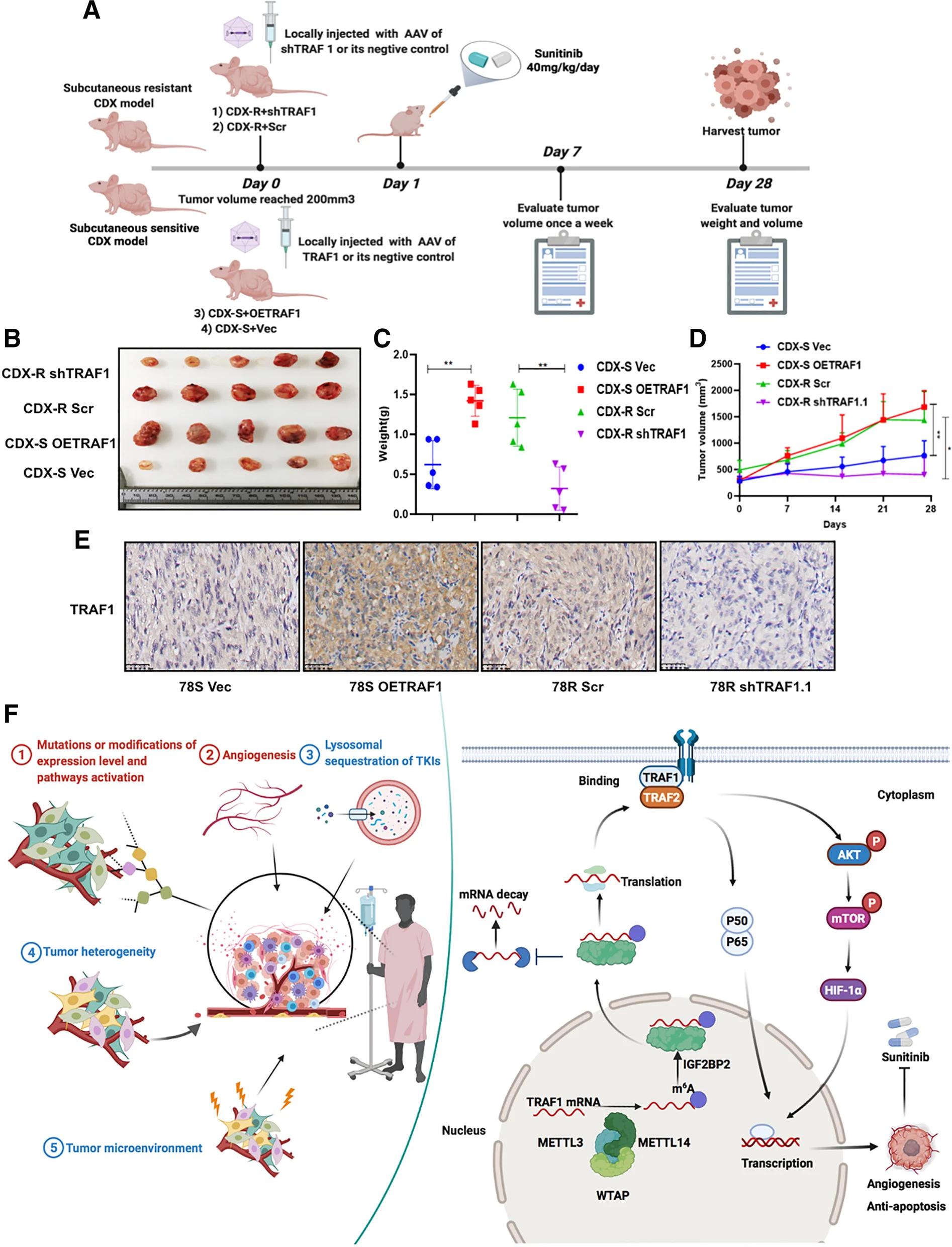
01 建立耐舒尼替尼的RCC细胞系和细胞衍生的异种移植模型
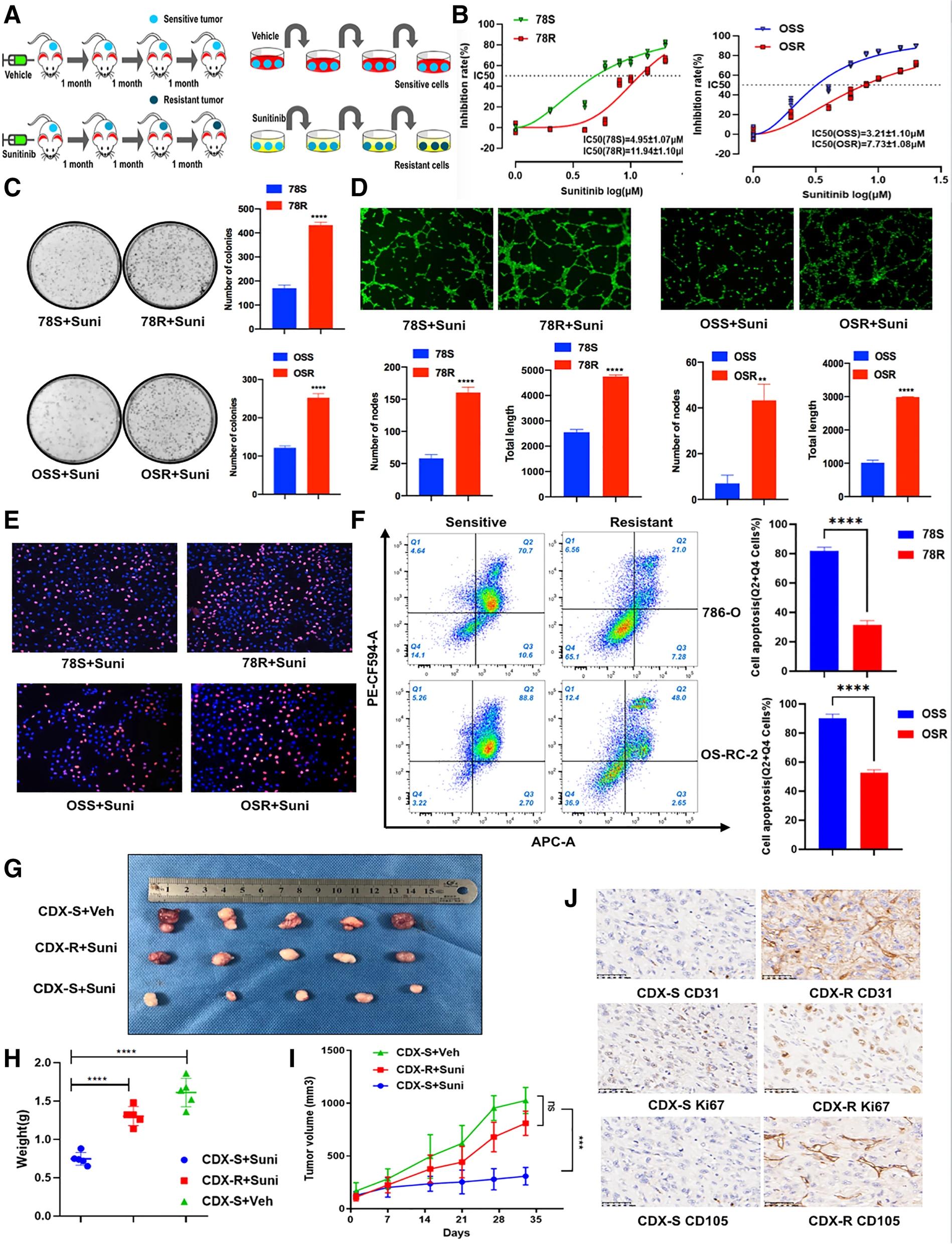
为了表征在体外和体内RCC中的RCC舒尼替尼耐药性,研究者们通过长期暴露于增加浓度的舒尼替尼,建立了两个RCC耐舒尼替尼的RCC细胞系(78R和OSR),并通过舒尼替尼口服治疗建立了耐药细胞源性异种移植物(CDX-R)模型(图1.A)。与相应的亲本细胞(78S和OSS)相比,78R和OSR细胞对舒尼替尼表现出较差的反应,如IC50增加,集落形成能力增加,舒尼替尼治疗下细胞凋亡减少和血管生成增加(图1.B-F)。为了建立细胞来源的异种移植模型,作者将786-O细胞植入裸鼠体内,并在体内三次传代期间用舒尼替尼治疗小鼠。为了验证传代3异种移植物(CDX-R)的耐药性,作者将CDX-R和CDX-S肿瘤植入裸鼠体内。结果表明,CDX-R肿瘤对舒尼替尼治疗的敏感性低于CDX-S肿瘤,如KI67,CD31和CD10水平升高所表明的那样(图1.G-J)。
02 TRAF1 在耐舒尼替尼 RCC 中的表达水平升高
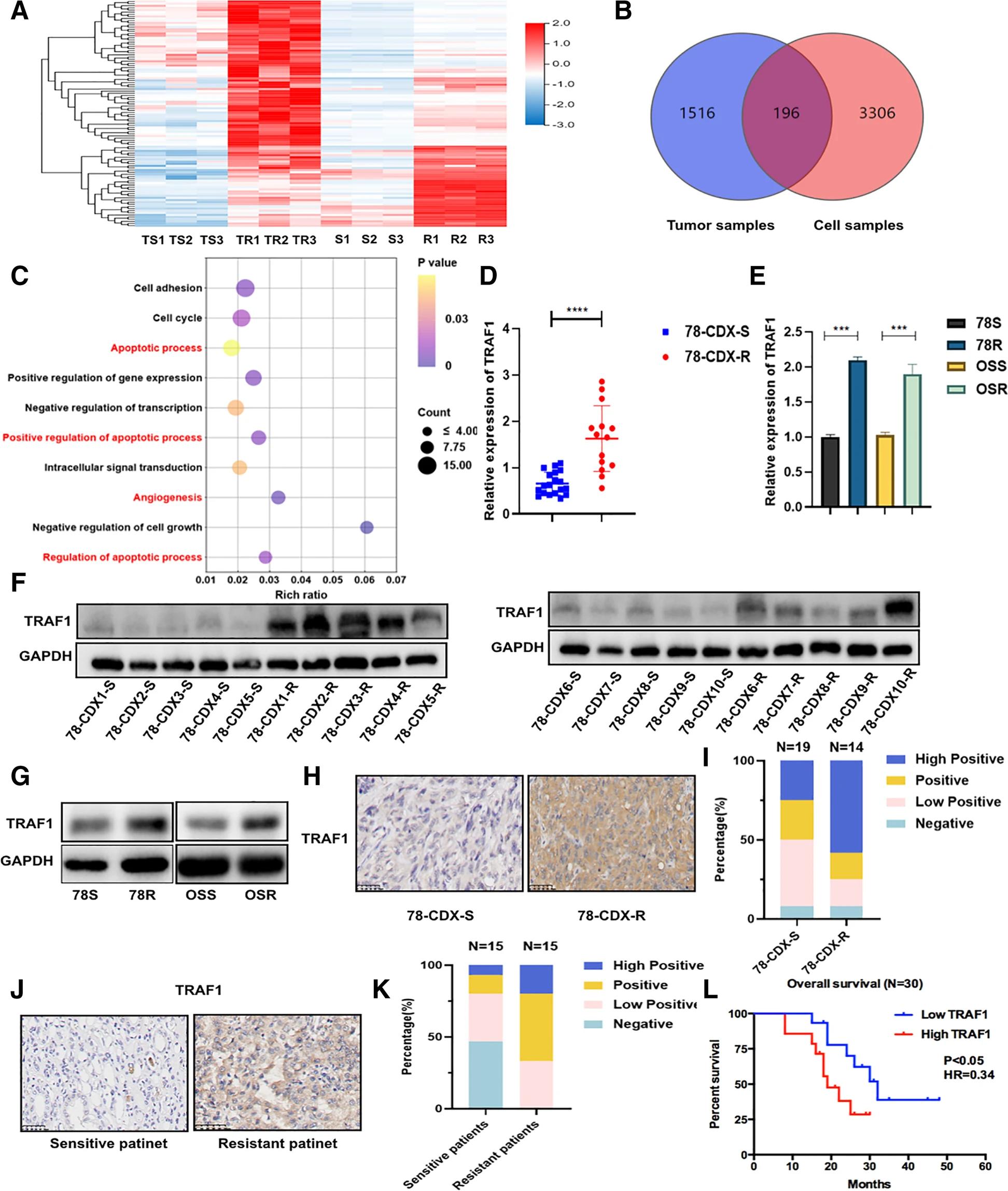
使用树对细胞和CDX样品进行RNA-seq分析,以研究与RCC中舒尼替尼耐药性相关的的关键基因(图2.A)。共鉴定了196个不同表达的基因,基因本体(GO)富集分析表明,血管生成和凋亡途径可能对舒尼替尼耐药性有影响(图2.B-C)。在舒尼替尼抗性细胞和CDX-R模型中,TRAF1的表达在RNA和蛋白质水平上均显着上调(图2.D-G)。通过对CDX样品进行IHC染色也观察到相同的结果(图2.H-I)。与这些发现一致,在对舒尼替尼反应较差的临床患者中,TRAF1阳性细胞的频率更高,染色强度更强(图2.J-K)。重要的是,TRAF1表达较高的患者表现出较差的总生存期(图2.L)。以上这些数据表明,TRAF1对舒尼替尼耐药性具有潜在重要性。
03 TRAF1对于促进舒尼替尼耐药性至关重要
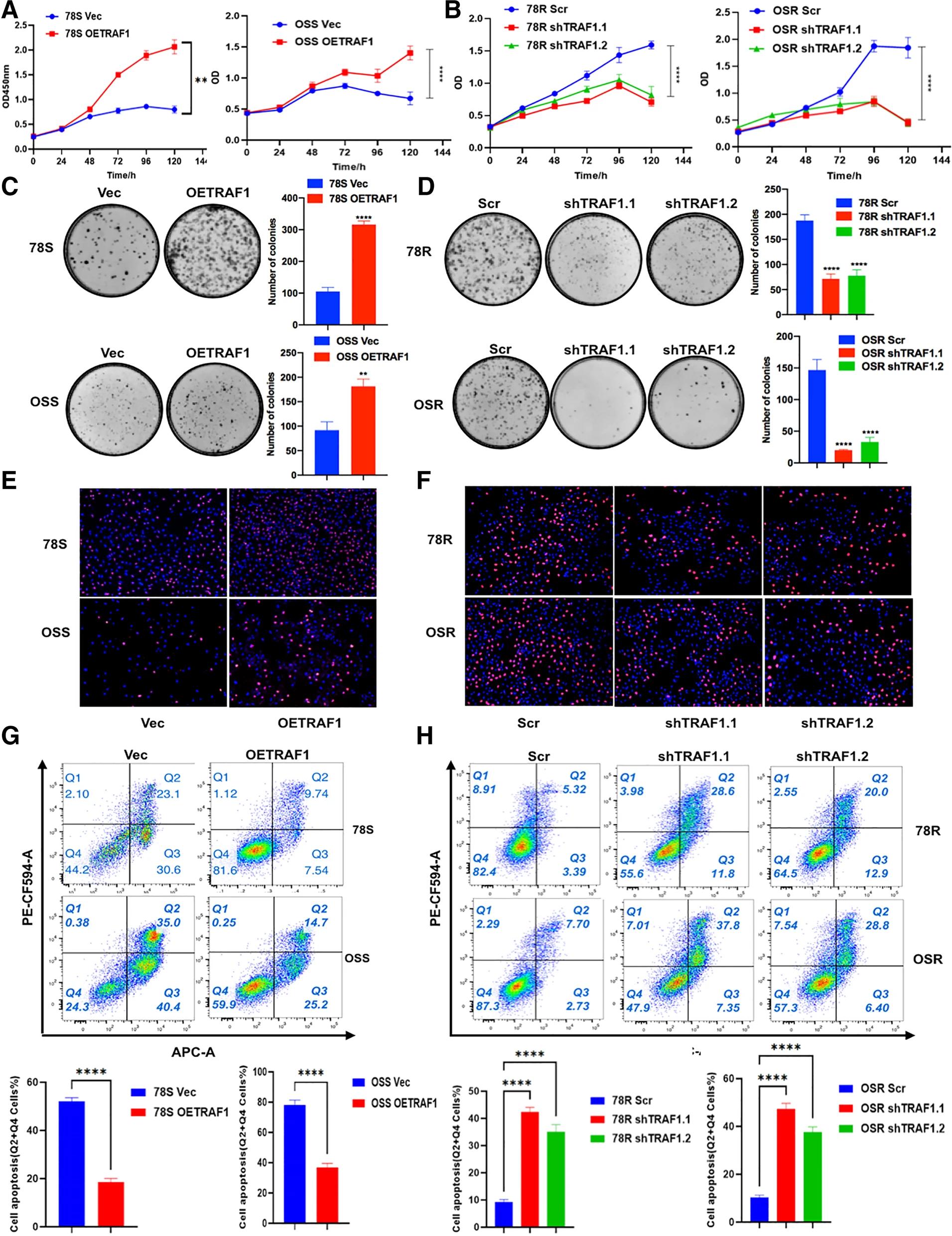
在TRAF1敲降的RCC舒尼替尼耐药细胞系中,舒尼替尼耐药性显著降低,而在TRAF1过表达细胞中,耐药性增加(图3.A-B)。同时,在菌落形成(图3.C-D)和EdU测定(图3.E-F)中观察到类似的结果,表明TRAF1在RCC的舒尼替尼耐药性中起关键作用。此外,流式细胞术分析进一步显示,TRAF1敲降时,舒尼替尼耐药细胞凋亡增加(图3.G),而TRAF1过表达时,舒尼替尼敏感细胞凋亡减少(图3.H)。
此外,管形成测定的结果表明,TRAF1过表达显着增强了血管生成(图4.A-B),并且TRAF1表达的减少抑制了血管生成(图4.C-D)。我们发现TRAF1的相对RNA表达水平与TCGA数据库中几个下游基因(mTOR,VEGFA,RELA和PARP)的表达水平之间存在正相关关系,表明TRAF1与这些基因之间存在潜在关联(图4.E)。然后使用Western Blot分析进一步研究参与舒尼替尼耐药性的特定下游蛋白质,显示TRAF1过表达显著激活AKT/mTOR/HIF1a/VEGFA途径(图4.F-G)。上述结果表明,TRAF1对于维持舒尼替尼耐药性至关重要,沉默TRAF1可通过抑制血管生成和诱导肿瘤细胞凋亡来增加舒尼替尼的效率。
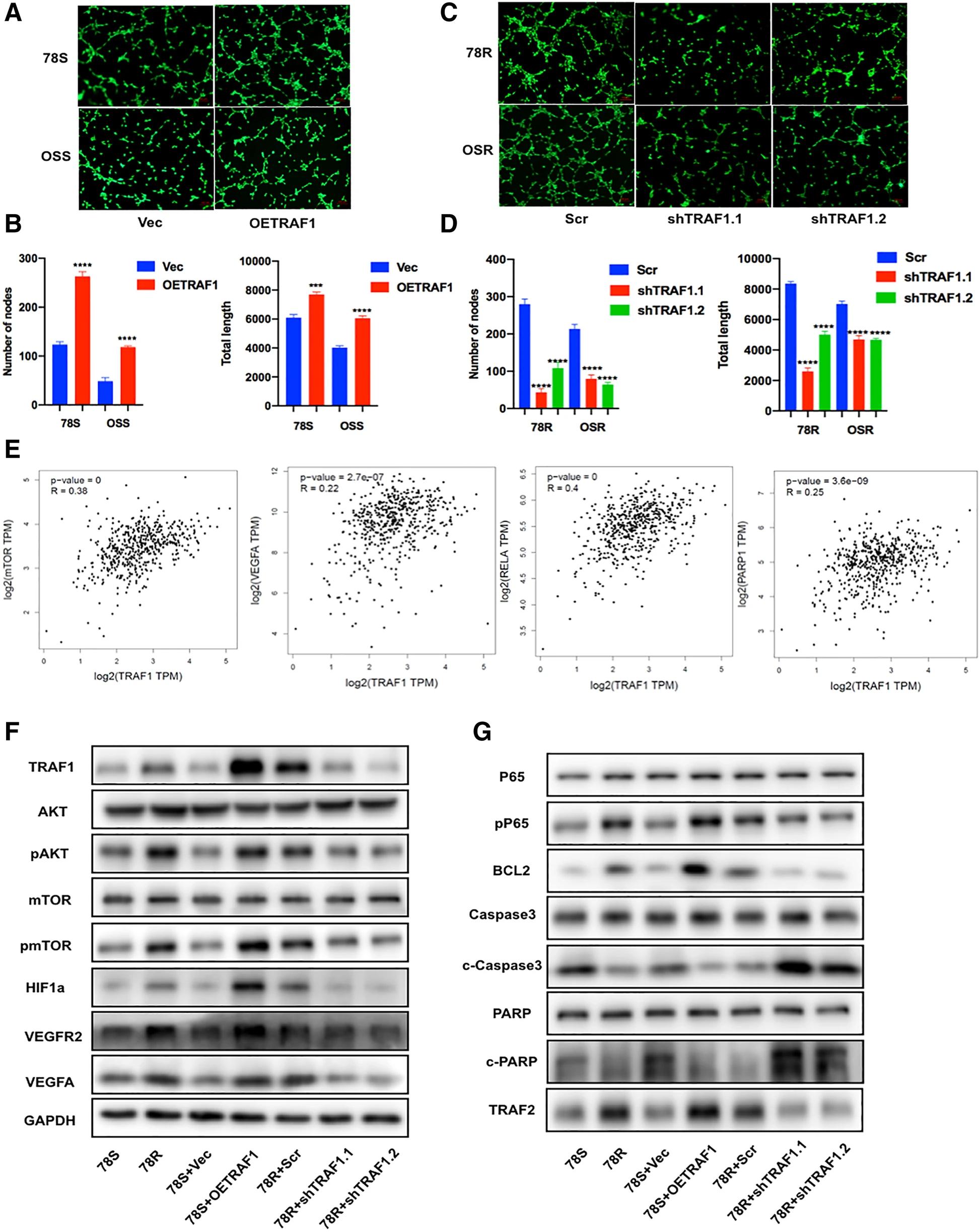
04 TRAF1受m6A RNA甲基化调节
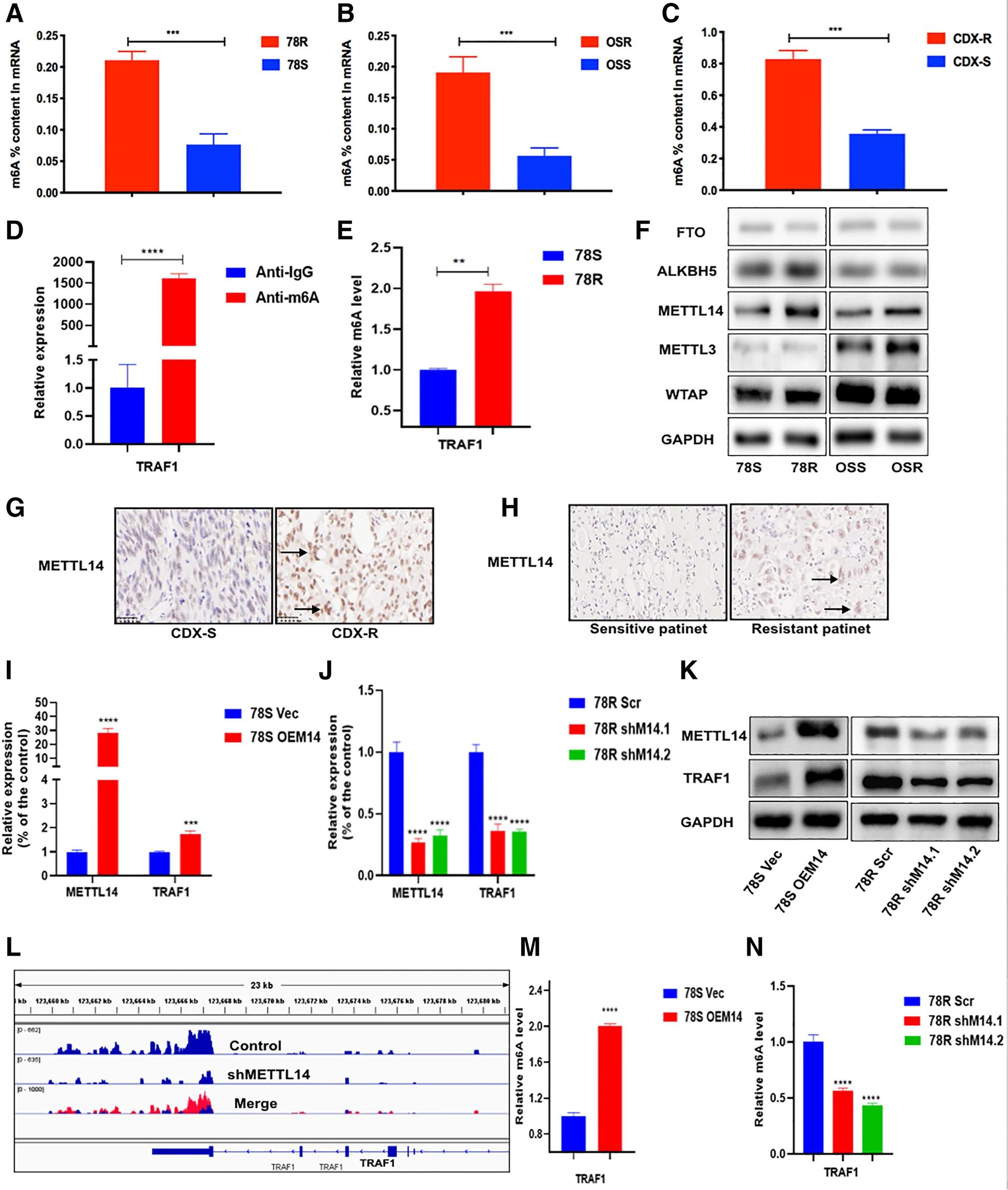
先前的研究表明,m6A是RNA中最丰富的碱基修饰,可以调节各种癌症中基因的表达。作者假设TRAF1的上调表达可能通过m6A修饰进行调节。首先,通过使用比色法检测整体RNA修饰水平,作者发现与亲本细胞系或CDX-S样品相比,舒尼替尼耐药细胞系和CDX-R样品中的m6A水平相应显著上调(图5.A-C)。此外,MeRIP-qPCR测定显示,与野生型细胞相比,在舒尼替尼耐药细胞中,TRAF1 mRNA中的m6A水平上调(图5.D-E)。为了进一步证实假设,作者测量了RCC细胞系中m6A RNA修饰相关酶,发现METTL14在舒尼替尼耐药细胞系中显著上调(图5.F)。为了进一步表征METTL14的表达,作者随后检测了其在CDX模型和临床患者样本中的表达,结果表明舒尼替尼耐药组织中METTL14表达显着增加(图 5.G-H)。此外,在RNA和蛋白质水平上,METTL14和TRAF1表达之间存在正相关关系(图5.I-K)。我们之前的m6A测序数据显示,在METTL14敲低细胞系中,TRAF1 mRNA转录本中的m6A水平随着TRAF1的表达而降低(图5J)。同时,m6A MeRIP-seq数据显示,在METTL14敲降细胞系中,TRAF1 mRNA转录本中的m6A水平随着TRAF1的表达而降低(图5.J)。与此结果一致,MeRIP-qPCR测定证实,当METTL14沉默或过表达时,TRAF1中的m6A水平相应降低或增加(图5.M-N)。综上所述,METTL14介导TRAF1 mRNA的m6A甲基化,正向调节舒尼替尼耐药RCC细胞中的TRAF1表达。
05 METTL14依赖m6A-IGF2BP2调节TRAF1的mRNA稳定性
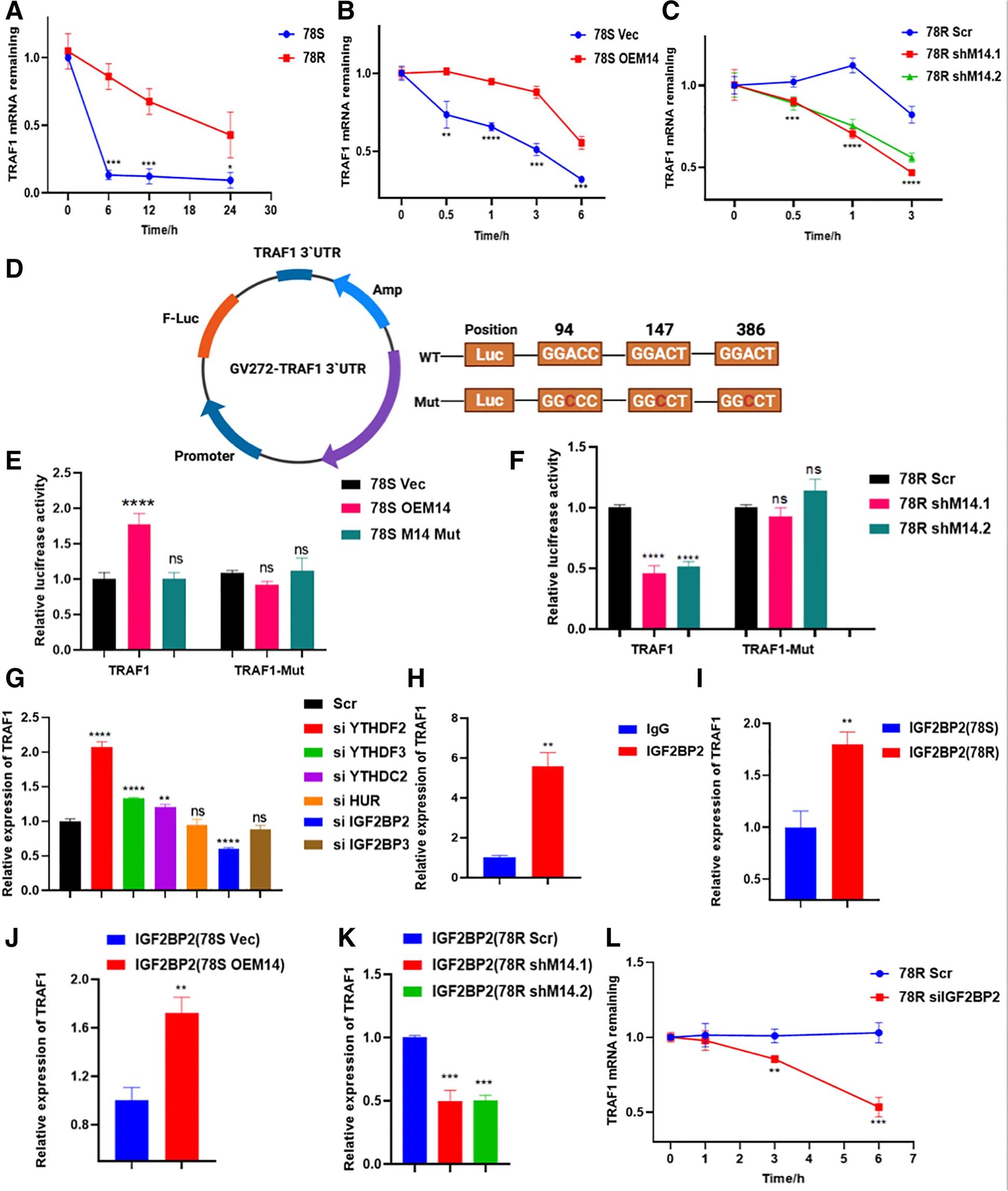
越来越多的证据表明,mRNA转录本上的m6A峰可以影响mRNA的稳定性。作者发现,与78S细胞相比,78R细胞中TRAF1转录本的半衰期增加(图6.A)。为了探讨METTL14是否通过调节其mRNA稳定性来调节TRAF1表达,作者用转录抑制剂放线菌素D(Act D)处理细胞,以测量调节METTL14表达时TRAF1转录本的半衰期。结果显示,METTL14的过表达导致TRAF1转录本的半衰期显著增加(图6.B),而METTL14的敲降导致TRAF1转录本的半衰期显著降低(图6.C)。为了进一步验证METTL14对TRAF1的调控取决于其mRNA转录本的甲基化这一假设,作者构建了具有TRAF1的3'UTR序列和相应突变体(Mut-3'UTR)序列的荧光素酶报告质粒(图6.D)。双荧光素酶实验结果表明,WT(但未发生突变)METTL14显著增强了TRAF1 3'UTR报告基因的表达(图6.E)。此外,野生型METTL14和突变的METTL14都不能影响mut-3'UTR的荧光素酶活性,这表明了RNA稳定性的m6A依赖性调节(图6.E-F)。
为了鉴定参与TRAF1调控的reader蛋白,作者设计了靶向已报道的可增强RNA稳定性的reader的小干扰RNA,结果显示IGF2BP2显著影响了TRAF1的表达(图6.G)。此外,RIP-qPCR显示IGF2BP2和TRAF1 mRNA之间的直接相互作用(图6.H)。同时,IGF2BP2和TRAF1转录本之间的直接相互作用在舒尼替尼耐药细胞系中更强(图6.I),而在调节METTL14表达后,此相互作用显著受到影响(图6.J-K)。TRAF1 mRNA稳定性在抑制IGF2BP2的细胞中受损(图 6.L)。总之,这些发现表明METTL14介导的m6A修饰以IGF2BP2依赖性方式增强TRAF1 mRNA稳定性。
06 TRAF1依赖METTL14维持舒尼替尼耐药性
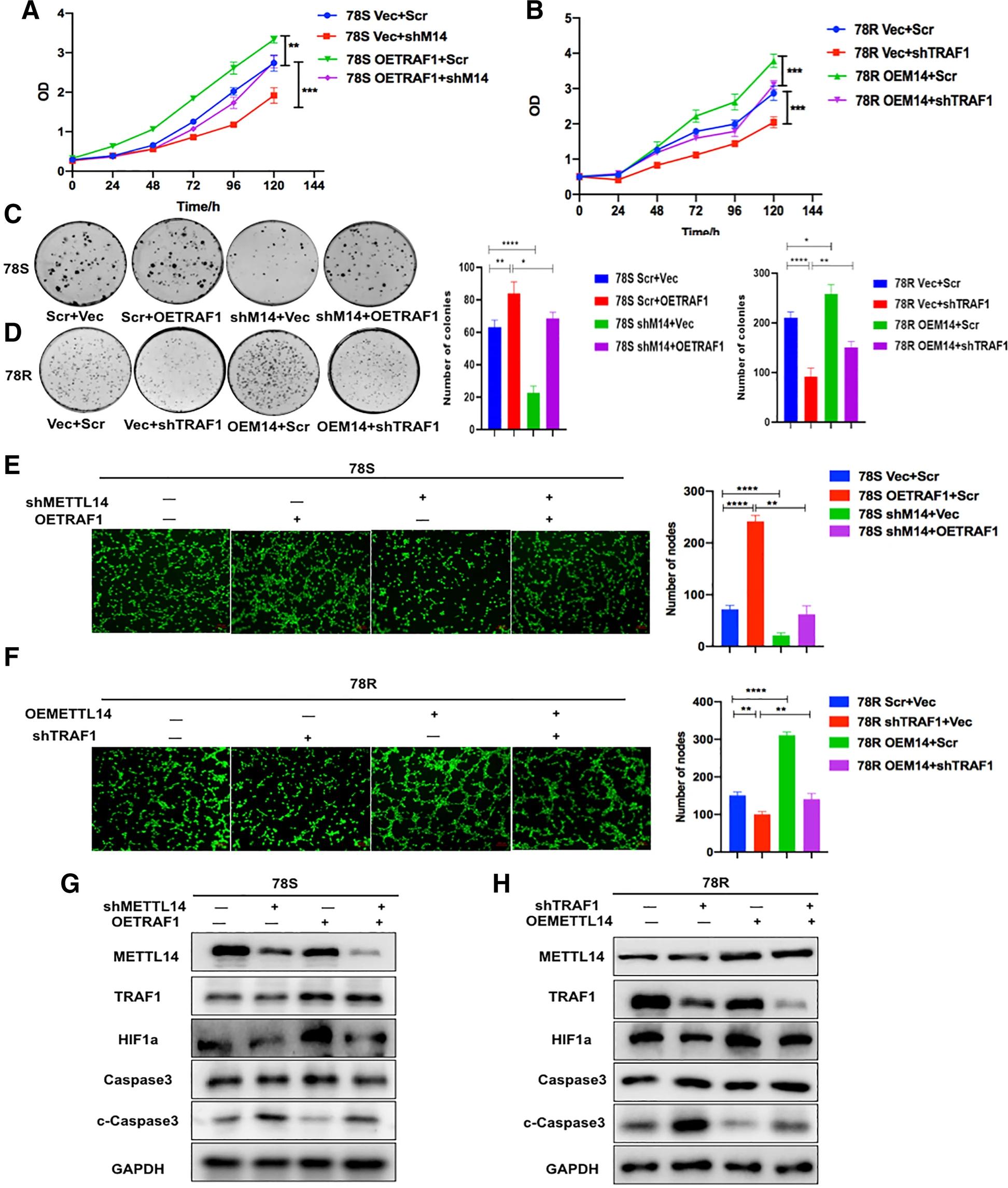
基于上述结果,作者假设TRAF1是METTL14在舒尼替尼耐药中的功能靶标。为了验证这一假设,作者进行了一系列挽救(rescue)实验。CCK-8(图7.A-B),菌落形成(图7.C-D)和管的形成(图7.E-F)测定结果显示,METTL14过表达的78R细胞对细胞凋亡和血管生成有显著抑制作用,而TRAF1的敲降降低了METTL14过表达对细胞凋亡和血管生成的增强效应。此外,在METTL14敲降细胞中观察到细胞凋亡和血管生成的显着增强,而TRAF1的过表达恢复了METTL14敲降产生的的抗凋亡和血管生成效应。Western Blot分析进一步证实,TRAF1通过以METTL14依赖性方式,调节凋亡和血管生成途径来促进舒尼替尼耐药性(图7.G-H)。
07 在体内靶向TRAF1抑制RCC中的舒尼替尼耐药性
为了进一步证明体外研究结果并探索其潜在的临床价值,作者采用了体内舒尼替尼耐药模型(图8.A)。在耐舒尼替尼的CDX小鼠的皮下植入部位周围局部注射sh-TRAF1的AAV可以显著恢复RCC细胞对舒尼替尼治疗的敏感性。相比之下,在CDX-S模型中,局部注射OE-TRAF1的AAV促进了舒尼替尼耐药性(图8.B-D)。与体外结果一致,IHC染色显示Ki67,CD31和CD105在sh-TRAF1处理的小鼠中的表达降低,表明sh-TRAF1处理的小鼠的抗凋亡和血管生成能力降低(图8.E)。此外,TRAF1高表达有助于在舒尼替尼耐药细胞中激活下游抗凋亡和血管生成途径(图8.F)。在不久的将来,靶向TRAF1可能是舒尼替尼治疗患者的一种新型药物干预。
m6A RNA修饰测序(m6A-meRIP-seq)
对m6A RNA甲基化,目前最流行的检测手段为m6A-MeRIP-Seq技术,适用于m6A RNA甲基化谱研究,快速筛选m6A RNA甲基化靶基因。云序可提供mRNA和多种非编码RNA的m6A测序:
- m6A 全转录组测序(涵盖mRNA,LncRNA,circRNA)
- m6A LncRNA测序(涵盖LncRNA和mRNA)
- m6A Pri-miRNA测序(涵盖Pri-miRNA和mRNA)
- m6A mRNA测序
- m6A miRNA测序
LC-MS/MS检测整体RNA修饰水平
精准高效,可以实现一次检测,9类修饰水平检测,一步到位。
比色法检测整体RNA修饰水平
快速检测m6A整体甲基化水平
03 m6A RNA修饰上游酶的筛选
m6A RNA修饰相关酶PCR芯片
寻找上游直接调控m6A RNA甲基化的甲基转移酶。
04 m6A RNA修饰靶基因验证
MeRIP-qPCR/GenSeq® MeRIP试剂盒
云序提供各类不同修饰的meRIP-qPCR服务以及销售GenSeq® MeRIP试剂盒,可针对mRNA,lncRNA,环状RNA等不同类型的RNA分子进行检测,低通量验证RNA修饰靶基因表达水平。05 机制互作研究
5.1 RIP-seq/qPCR/GenSeq® RIP试剂盒
上海云序生物科技有限公司 商家主页
地 址: 上海市松江区莘砖公路518号24号楼4楼
联系人: 戴小姐
电 话: 021-64878766
传 真: 021-64878766
Email:market@cloud-seq.com.cn;liuqingqing@cloud-seq.com.cn
