近日,复旦大学生科院卢大儒教授团队在《Human Genetics》上发表了《CRISPR/Cas9-mediated somatic and germline gene correction to restore hemostasis in hemophilia B mice》,文章揭示了在血友病B(Hemophilia B)型小鼠中,CRISPR/Cas9能够通过介导基因修复,重塑小鼠的凝血功能。

血友病B(HB)是研究基因治疗的理想模型。HB是一种X染色体遗传的血液性疾病,是由于凝血因子FIX(F9编码的凝血因子,F9 encoded coagulation factor IX)的功能性缺失导致的。最初治疗HB采用的是凝血因子补充疗法(通过浓缩或者重组FIX),然而,FIX的半衰期只有24h,因此,基因治疗可能是更加适合的治疗方法。传统的基因治疗方法是通过病毒将F9基因转染到动物或病人的肝脏、肌肉、成纤维细胞中,然而,由于病毒载体所带来的毒性仍在评估,并且存在基因组整合的风险,因此基因的定点修复是研究基因治疗的理想模型。
当外源提供donorDNA模板时,突变的DNA位点处可以通过同源重组(homology directed repair,HDR)进行修复。机体自发的HDR频率较低,只有1×10−6,而CRISPR/Cas9可以增加HDR的几率。由于CRISPR/Cas9具有基因编辑效率高、可操作性高、成本低等明显优势,现在已经被广泛应用于小鼠胚胎、细胞系、诱导多能干细胞等DNA突变的HDR。CRISPR/Cas9基因编辑系统在基因治疗上具有广阔的前景。
卢教授团队选取了患有严重血友病的小鼠作为研究对象,对成年小鼠进行尾静脉注射(hydrodynamic tail vein,HTV)导入Cas9表达质粒,其凝血功能得到了部分缓解。体外显微注射小鼠的生殖细胞时,Cas9蛋白更为安全,并且具有较高的修复效率。
卢教授团队首先突变了小鼠的第8个外显子,在高度保守的结构域中造成了8bp的缺失,使得FIX无法活化,突变后的小鼠被称为F9 KO 小鼠。mRNA和蛋白水平上的研究标明,F9 KO 小鼠可以用作研究HB的理想模型。
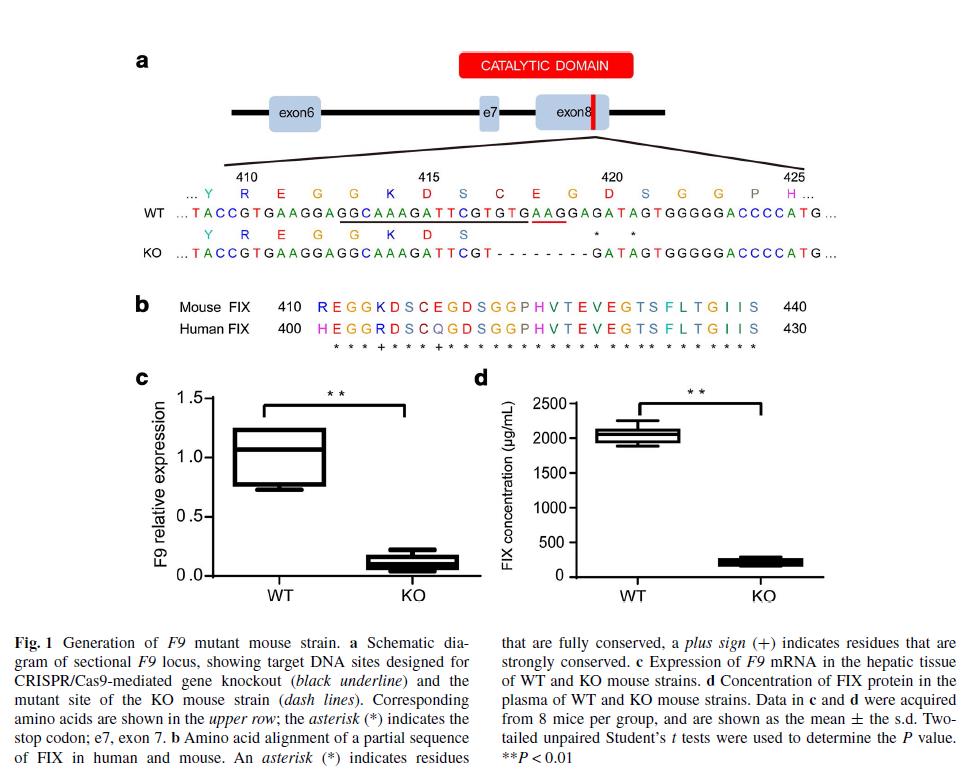
肝脏是唯一表达FIX的器官,将Cas9-sgRNA和donor DNA的质粒通过HTV的方式导入小鼠的肝细胞。6周后进行检测。结果表明,与对照组小鼠(只注射了donor DNA)相比,75%的实验组小鼠基因得到了修复,而对照组小鼠的基因修复率为0%。此外,实验组小鼠的F9基因在血浆和肝脏中的表达量是对照组小鼠的3.39倍。Cas9-HTV处理的小鼠血浆中,FIX的含量增加至正常水平,也显示了较好的治疗效果。


HB小鼠经过Cas9-DNA转染处理后,基因被修复,但是这种被修复的性状不能遗传。为了比较不同的Cas9形式对基因修复效率和安全性的影响,卢教授团队将Cas9的三种形式,Cas9 mRNA,Sp Cas9蛋白(Cas9-wt)和高保真的Sp Cas9蛋白(Cas9-HF),显微注射进F9 KO小鼠的胚胎中。培养2天后,更多注射了Cas9蛋白的胚胎发育为囊胚,且出生率是注射mRNA的1.56倍,该试验结果也表明Cas9蛋白的注射方式对胚胎的毒性更小。
同时,注射Cas9蛋白的基因修复效率较高。测序结果显示,注射了Cas9-wt的胚胎中,52.6%的F9基因得到了修复,是注射了Cas9 mRNA的1.62倍。此外,70%的注射了Cas9-wt的胚胎发生了纯合/杂合修复,意味着它们可能产生没有缺陷基因的配子。Cas9-HF实验组胚胎的成活率和基因修复也明显高于Cas9 mRNA实验组,但DNA修复效率略低于Cas9-wt实验组胚胎。检测新生小鼠的治疗效果,与F9 KO小鼠相比,注射了Cas9的小鼠的FIX浓度更高,暗示了Cas9介导的基因治疗方法效果卓然。
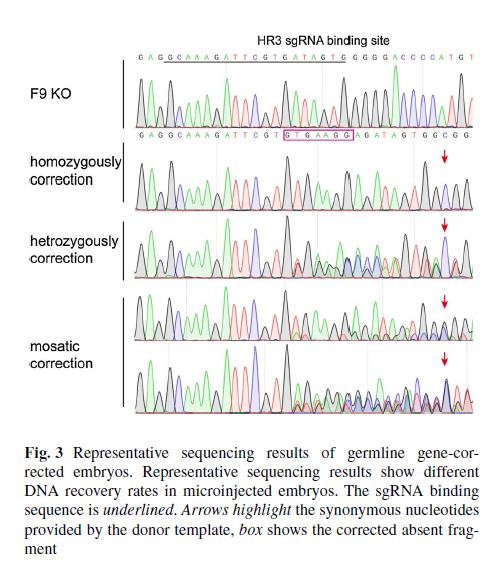
卢教授团队不仅揭示了CRISPR/Cas9可以通过基因编辑对基因进行修复,在基因治疗领域有着更广阔的前景,也证明了与Cas9的其他形式相比,Cas9蛋白有更高的修复效率以及更低的胚胎毒性。
