NK细胞的安全性及其广谱的抗肿瘤作用,使其被视为细胞治疗界继CAR-T、TCR-T等的另一个炙手可热的当红炸子鸡。NK细胞通过其表面激活受体和抑制受体表达的刺激信号与抑制信号来平衡对靶细胞的应答和耐受。目前对NK细胞激活受体和抑制受体信号传导的机制仍有待更多的探索和研究,包括通过哪些方法可以促进NK细胞激活受体,增强其对抗癌细胞的功能也是目前的研究热点之一。
近期发表在Communication Biology的一篇题目为:Tumor-derived NKG2D ligand sMIC reprograms NK cells to an inflammatory phenotype through CBM signalosome activation的文章通过IsoPlexis技术对NK细胞单细胞水平的功能蛋白质检测,探索了肿瘤微环境如何通过分泌能引发NK细胞产生强烈促炎效应的sMIC,实现免疫逃逸。该项研究填补了大家对NK细胞的抑制性信号通路机制理解的空白,并提出了避免抑制性信号通路导致的肿瘤免疫逃逸的可行方案。
NKG2D是几乎在所有NK细胞表面都表达的一类激活性受体,通过结合特异性的NKG2D配体发挥激活作用。NKG2D配体通常表达在一些经历炎症反应的细胞上,如发生癌变或病毒感染的细胞。MIC是一种表达在癌变早期细胞上的NKG2D配体,其与NKG2D受体的相互作用对于NK细胞状态的影响目前还没有清楚的认知。
![]()
文章解读
![]()
在这篇文章中Dhar等研究人员探索了存在肿瘤微环境中的可溶性MIC(sMIC)和结合在细胞表面的MIC(mMIC)对NK细胞功能影响的机制。有研究表明sMIC会下调NKG2D表达,降低NK细胞的细胞毒功能。该研究团队通过多组学分析发现sMIC的存在会使NK细胞在转录组水平出现与炎症、促肿瘤生长的细胞因子和趋化因子,如IL-10、CCL1、CCL3的基因的富集。而与细胞毒功能相关的基因则发生了下调。
作者通过IsoPlexis的单细胞功能蛋白组学技术检测了NK细胞的多功能性。发现与sMIC共培养后,NK细胞的多功能性显著降低,同时与细胞毒功能相关的效应细胞因子的分泌也显著减少。在使用一种可以特异性清除sMIC的抗体后,则可以消除sMIC导致的这种多功能性降低及细胞毒性细胞因子减少的效应。由此作者推断sMIC通过CBM复合体信号通路调节NK细胞的细胞毒功能,且sMIC可以降低NK细胞的多功能性。
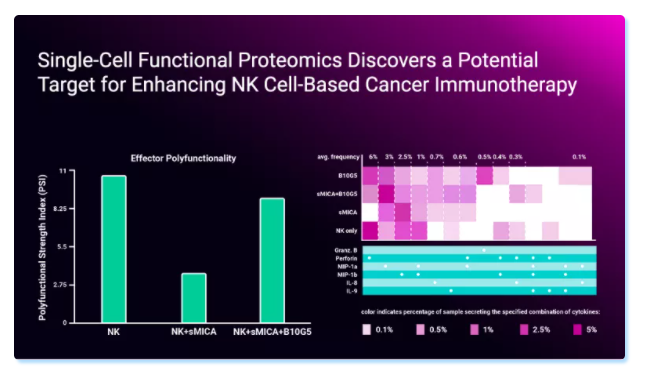
与此相反,mMIC并不会降低NK细胞的功能。作者通过杀伤试验和免疫印迹试验都证实NK细胞与表达mMIC的肿瘤细胞共培养后都表现出增强的肿瘤杀伤活性。
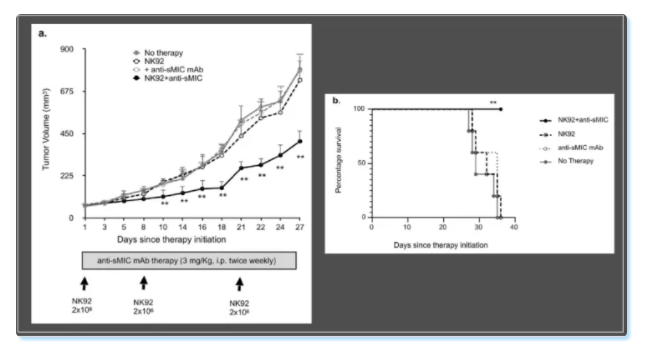
紧接着作者通过一个移植瘤小鼠模型对这个体外的发现进行了体内实验的验证。将既表达sMIC,又表达mMIC的胰腺癌细胞移植给小鼠,然后给予小鼠NK细胞治疗。小鼠肿瘤病灶并未因NK细胞的治疗得到有效清除,反而增大,且因疾病进展而发生死亡;但给予NK细胞治疗同时给予小鼠抗sMIC抗体治疗时,小鼠肿瘤病灶则得到显著的清除并获得更好的生存,这与体外试验的结论是一致的。
![]()
该研究让大家对于促进肿瘤生长和疾病进展的NK细胞促炎反应的机制有了更深入的认识。能更深入地了解由刺激信号和抑制信号共同平衡调节的NK细胞的抗肿瘤效应,以及由抑制信号介导的促肿瘤效应如何可以被消除掉。对于目前开展的一系列NK或CAR-NK疗法的研发具有重要的指导意义。IsoPlexis技术从单细胞维度验证了sMIC对NK细胞免疫应答功能的影响,对于研究NK细胞激活受体和抑制受体信号传导的机制是非常有帮助的。
![]()
![]()
参考文献
1. Payal Dhar et al. “Tumor-derived NKG2D ligand sMIC reprograms NK cells to an inflammatory phenotype through CBM signalosome activation.” COMMUNICATIONS BIOLOGY | (2021) 4:905 | https://doi.org/10.1038/s42003-021-02440-3 | www.nature.com/commsbio
2. Eissmann, P. (n.d.). Natural killer cells. British Society for Immunology. https://www.immunology.org/public-information/bitesized-immunology/cells/natural-killer-cells
3. Cerwenka, A et al. “Ectopic expression of retinoic acid early inducible-1 gene (RAE-1) permits natural killer cell-mediated rejection of a MHC class I-bearing tumor in vivo.” Proceedings of the National Academy of Sciences of the United States of America 98,20 (2001): 11521-6. doi:10.1073/pnas.201238598
4. Dhar, Payal, and Jennifer D Wu. “NKG2D and its ligands in cancer.” Current opinion in immunology 51 (2018): 55-61. doi:10.1016/j.coi.2018.02.004
5. Dhar P, et al. Tumor-derived NKG2D ligand sMIC reprograms NK cells to an inflammatory phenotype through CBM signalosome activation. Communications Biology 2021; 4(905).
Wu, Jennifer D et al. “Prevalent expression of the immunostimulatory MHC class I chain-related molecule is counteracted by shedding in prostate cancer.” The Journal of clinical investigation 114,4 (2004): 560-8. doi:10.1172/JCI22206
